
23 апреля 2019 года закончилась патентная война за право называться первооткрывателями технологии CRISPR/Cas. Ее вели несколько крупных научных центров. Патент на одно из самых выдающихся открытий в области биологии получили Эммануэль Шарпантье, Дженнифер Дудна, Мартин Джинек и Кшиштоф Хылински (университеты Калифорнии и Вены, а Массачусетский технологический университет остался за бортом).
Генная инженерия — одна из самых перспективных областей науки. Возможность изменять живые организмы на уровне их генов — непаханое поле для работы, а с недавних пор работа по редактированию человеческого генома буквально кипит. Это стало возможным благодаря изучению и развитию технологии редактирование генома CRISPR/Cas.

Наследственные болезни
Причиной генетических болезней становится мутация в генах. Она может передаться от кого-то из родителей, а может возникнуть сама по себе. Если представить себе гены как компоненты программы, по которой создается человек, то мутация — это ошибка в такой программе. Насчитывают более 6000 видов наследственных заболеваний. Поскольку до недавнего времени не существовало технологий, способных справиться с причиной наследственной болезни, то есть «починить» дефектный ген, то лечение предлагалось в основном симптоматическое — его целью было смягчить проявления болезни.
Казалось бы, технология CRISPR/Cas может помочь в удалении причины патологии, той самой мутации: нужно «всего лишь» сперва вырезать с ее помощью дефектную последовательность, а затем запустить в организм безопасный вирус, спроектированный так, чтобы он мог доставить в нужное место и разместить там «правильный» фрагмент ДНК. Однако не все так просто. На нынешнем этапе развития технология изучена недостаточно. Хотя опыты с растениями начались уже в 2012 году, сразу же после того, как был представлен сам метод, а затем «подключили» и животных, о полноценной генной терапии для человека говорить еще рано.
Обратная сторона силы
Эксперименты показали, что внешняя управляемость системы CRISPR/Cas — это миф. Да, технология работала, но она меняла не только тот фрагмент ДНК, который планировалось, но и некоторые другие фрагменты. Сперва дополнительные изменения казались небольшими, но в 2018 году ученые из Кембриджа обнаружили, что CRISPR/Cas может удалять последовательности из тысяч оснований ДНК или даже полностью переделывать их. Выяснилось это случайно — группа специалистов под руководством Майкла Косицки попробовала изменить участки ДНК, которые до них еще никто не трогал, — некодирующие гены под названием «интроны». Казалось бы, перемены в этих генах вообще не должны затрагивать работу остальных, но на деле после воздействия CRISPR ДНК в некоторых клетках вообще исчезла. Руководитель группы заявил, что при лечении смертельных заболеваний такой риск, возможно, оправдан, но в любом случае технология требует самых тщательных изысканий.

С учетом того, что сама технология открыта только в 2012 году, как проявит себя генная терапия у людей в долгосрочной перспективе, предугадать пока нельзя. Предшественники CRISPR/Cas проявили себя не слишком хорошо — так, в 1999 году при введении «безопасного» вируса с нужной генетической информацией в организм 18-летнего юноши у него активизировалась иммунная система, что в конечном итоге привело к его смерти. В 2014 году при лечении «синдрома мальчика в пузыре» (тяжелого комбинированного иммунодефицита) у некоторых больных развился лейкоз как побочный эффект из-за активации онкогена. Некоторое количество исследований показало, что применение генной инженерии снижает устойчивость организма к раку.
На данный момент полноценные масштабные исследования именно CRISPR/Cas на людях еще не начались. В 2016 году в Китае впервые использовали эту технологию для изменения генома пациента с агрессивным раком легких (он был одним из 10 участников мини-исследования), и результаты использования пока не известны. Лидер научной группы Лу Ю в одной из своих публикаций акцентировал внимание на том, что необходим государственный контроль за применением технологии, так как она может стать инструментом не для лечения, а для получения прибыли, кроме того, генетическая модификация остро ставит вопросы этики.
Подтверждением такой необходимости стали эксперименты другого китайского ученого — Хэ Цзянькуя. В 2018 году он заявил, что модифицировал геном двух эмбрионов женского пола таким образом, чтобы они не могли заразиться ВИЧ — после процедуры ЭКО «отключил» ген CCR5, с помощью которого вирус проникает в организм человека. Редактирование генома зародышей проводилось и до Цзянькуя, но это были нежизнеспособные эмбрионы (из этических же соображений), а в его случае родились две здоровые (по словам специалиста) девочки. Их мать была здорова, отец — носитель ВИЧ. Власти Китая подтвердили, что опыты Хэ Цзянькуя действительно происходили, однако как руководство страны, так и университет, в котором работал ученый, выступили против несанкционированных исследований (подобная работа в Китае запрещена).

Цзянькуя отстранили от работы, университет заявил, что не имеет к его работе никакого отношения. Действительно ли дети здоровы, восприимчивы ли они к ВИЧ, и будут ли какие-либо еще последствия у редактирования их генома (в том числе у их потомства) — неизвестно. Мало того, сама идея деактивации гена CCR5 довольно сомнительна: ВИЧ в современном мире вполне поддается контролю, антиретровирусная терапия неоднократно показала свою эффективность. Даже если ребенок рождается у ВИЧ-инфицированной матери, лекарства могут снизить риск заражения младенца до 2-3%. Фактически Хэ Цзянькуй использовал непроверенную технологию в ситуации, не угрожавшей жизни человека. При этом ВИЧ все еще может попасть в организмы девочек другим способом, а изменение гена CCR5 делает детей более восприимчивыми к гриппу и лихорадке Западного Нила. Родителям Лулу и Наны Цзянькуй сказал, что разрабатывает вакцину от ВИЧ, то есть при подписании согласия они не знали, на что соглашаются.
Впрочем, документы ученый подделывал в течение всего времени своей работы. Последние новости о нем были опубликованы в январе 2019 года — на тот момент он находился под охраной и ждал суда. Что с ним происходит сейчас — неизвестно. Агентство «Синьхуа» тогда же в январе сообщало, что Цзянькуй будет наказан в соответствии с законодательством — возможно, это уже произошло. Этот случай иллюстрирует, насколько опасной может стать революционная технология в руках недобросовестного человека.
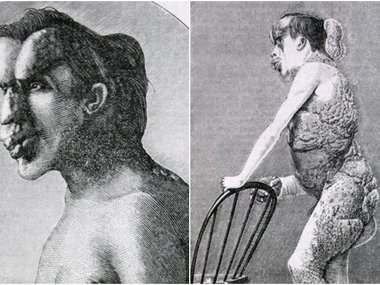
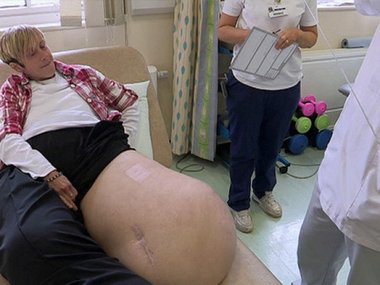
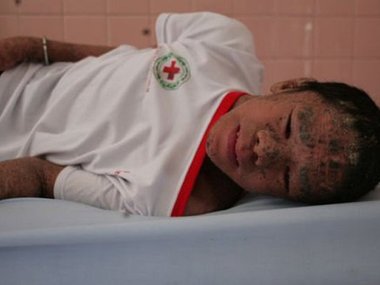
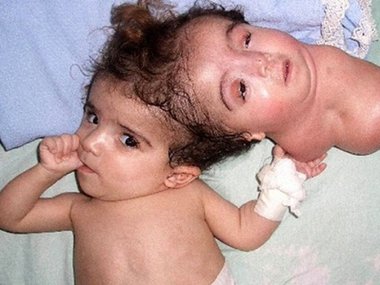
Посмотрите также галерею людей с аномалиями, к которыми привели вчастности и генетические мутации.

Другая сторона вопроса связана с ситуациями, в которых допустимо прибегать к редактированию генома. Национальная академия наук США настоятельно рекомендует использовать генную инженерию, только когда это необходимо по медицинским показаниям, а не когда, например, родителям захочется изменить геном своих детей, чтобы сделать их более умными, сильными или талантливыми. В последнем случае — поскольку генная инженерия достаточно дорога — бесконтрольное ее применение приведет к дальнейшему расслоению общества: богатые будут иметь возможность изменять свои гены как им захочется, а у бедных такой возможности не будет.
Еще одна проблема — невозможность получить действительно информированное согласие родителей при редактировании генома детей — никто не знает, какими могут быть долгосрочные последствия изменений, они могут проявиться и спустя поколения. Специалисты предупреждают: хотя многие ученые считают, что они полностью контролируют свои эксперименты, всегда есть вероятность ошибки, а в случае генной инженерии эта ошибка может распространиться по всему миру, и контролировать этот процесс будет невозможно. Опасность так велика, что, например, бывший директор Института национального здравоохранения призвал полностью прекратить работу по крайней мере над теми направлении в CRISPR, которые относятся к мутациям, способным передаваться между поколениями.
Тем не менее нельзя сказать, что технология CRISPR/Cas и другие разновидности генной инженерии — это провальный путь. Если они будут находиться под жестким контролем государства и применяться только в случаях жизненной необходимости — это будет спасение для людей с наследственными заболеваниями. Однако пока соответствующие правовые нормы еще не разработаны, сами технологии изучены недостаточно и мировое сообщество еще не пришло к консенсусу относительно их этичности, к повсеместному использованию генной инженерии мир еще не готов.

Взгляд в историю
Все началось в 1987 году, когда японские ученые обнаружили в геноме кишечной палочки странные повторяющиеся последовательности, между которыми, в свою очередь, располагались разнообразные фрагменты ДНК. На тот момент назначение этих последовательностей было неясным. В 1993 году аналогичные последовательности были обнаружены у археи Haloferax mediterranei испанцем Франсиско Мохикой. Повторы стали называть «короткими палиндромными повторами, регулярно расположенными группами» (clustered regularly interspaced short palindromic repeats или CRISPR). Участки ДНК между ними также получили имя — они называются спейсеры от английского слова space — «пространство».
Дальнейшее изучение показало, что ДНК, представленная в спейсерах, соответствует ДНК вирусов-бактериофагов. Встреча с новым вирусом приводила к созданию нового спейсера. После серии экспериментов, завершившейся в 2007 году, ученые определили CRISPR как «библиотеку» знаний о вирусах. Если бактерия встречала повторно какой-либо вирус-бактериофаг, она передавала данные из «библиотеки» белкам Сas — это белки, которые отвечают в том числе за разрушение враждебной ДНК. Соответственно, они уничтожали бактериофаг «по наводке», при этом наводчиком выступала РНК, синтезированная бактерией в соответствии с типом узнанного бактериофага.
В 2012 году специалисты из нескольких университетов (независимо друг от друга, собственно, с тех пор и велась война за патент) предложили способ редактирования генома с помощью CRISPR/Cas: этот способ заключается в том, что ученые (или врачи), создавая определенные РНК, указывают белку Cas, какую именно последовательность в ДНК необходимо разрушить. Это и открыло дорогу для исследования CRISPR/Cas как метода лечения генетических заболеваний.
Посмотрите тажке галерею биохакеров — людей, которые пытаются обмануть природу.





